-
文/《猪病学》第11版
-
译/ 猪倌张军
非洲猪瘟
JoséManuelSánchez‐Vizcaíno,AlbertoLaddomada,andMarisaL
致病机理
ASFV主要在病毒入侵部位附近淋巴结的单核细胞和巨噬细胞中进行复制。经口感染时,病毒首先在扁桃体和下颌淋巴结的单核细胞和巨噬细胞中进行复制,然后经血液和/或淋巴转移至病毒二次复制的场所-淋巴结、骨髓、脾、肺、肝和肾。病毒血症通常在感染后4-8天出现,由于缺乏中和抗体,将持续数周或数月。
ASFV主要在单核细胞和巨噬细胞中复制(Mínguez等,1988),也会在内皮细胞(Wilkinson和 Wardley,1978)、肝细胞、肾小管上皮细胞 (Gómez‐Villamandos等,1995)和中性粒细胞(Carrasco等,1996)复制。目前还没有发现在B淋巴细胞和T淋巴细胞复制。病毒进入易感细胞是通过受体介导的内吞作用(Alcamí等,1989),然后在细胞核附近的不同细胞质中复制。ASFV在单核细胞和衍生的巨噬细胞亚群中的相互作用研究表明,病毒具有抵消巨噬细胞活性反应的进化机能,从而促进病毒的存活,在宿主中传播,造成ASFV发病 (Franzoni等,2017)。ASFV易于血液细胞膜(Quintero等,1986) 和血小板 (Gómez‐Villamandos等,1996)相互作用,能够引起感染猪的血细胞吸附现象。但有些分离毒株不会诱导红细胞吸附现象。
急性病例中的出血机理是由于疾病后期,在内皮细胞中复制的病毒使内皮细胞的吞噬活性增强引起的。相反,亚急性病例的出血机理主要是因为血管壁的通透性升高而引起的 (Gómez‐Villamandos等,1995)。急性病例中淋巴细胞减少的机理与淋巴器官的T区淋巴细胞凋亡有关 (Carrasco等,1996),这种凋亡并非发生在病毒复制过程中,因为还没有证据表明ASFV能在T细胞和B细胞中复制。但可能涉及其他机制,例如,ASFV感染的巨噬细胞释放细胞因子或细胞凋亡因子(Oura等,1998)。
亚急性非洲猪瘟表现为暂时性血小板减少 (Gómez‐Villamandos等,1996)。ASFV急性和亚急性的后期可观察到肺泡水肿,是ASFV致死的主要原因,这种水肿是肺血管内巨噬细胞的活化造成的(Sierra等,1990)。
临床症状
非洲野猪对该病有很强的抵抗力,一般不表现出临床症状。不管是急性还是慢性感染,家猪和欧洲野猪表现有明显的临床症状,ASF的临床症状和许多其他猪的疾病类似,特别是猪瘟(猪霍乱)和猪丹毒。
ASFV自然感染的潜伏期为4-19天。在实验条件下,潜伏期可以缩短为2-5天,潜伏期的长短与接种的剂量和接种的途径有关(Mebus等,1983)。ASF临床表现取决于该毒株的毒力、接触时间、感染的途径。高毒力毒株导致超急性和急性发病,中等毒力造成多种临床症状:急性、亚急性、和慢性或不明显症状。低毒力毒株造成亚急性、慢性、或不明显的发病。
发病率在40-85%之间,取决于该毒株是引起急性还是慢性发病,病毒毒力,感染途径和是否存在出血(上位显性或者是出血性腹泻)。高毒力死亡率可高达90-100%,中毒力能引起20-40%的死亡率,在幼年动物能引起70-80%的死亡率,低毒力能造成10-30%的死亡率。
超急性
ASF 的超急性特点是厌食、体温 > 41°c、抑郁和皮肤充血。通常临床症状出现1-4天后死亡。超急性通常发生在ASF第一次爆发区。
急性
疾病的急性形式的特点是厌食, 体温升高 (40–42°c,104–108°F), 不愿活动, 早期白细胞减少, 肺水肿,广泛的淋巴组织坏死和出血,皮肤出血 (尤其是耳朵和两边的皮肤)、脾肿大和高死亡率 (Mebus等,1983)。在最后阶段,可见急促的呼吸,以及肺水肿引起的鼻腔分泌大量粘液。

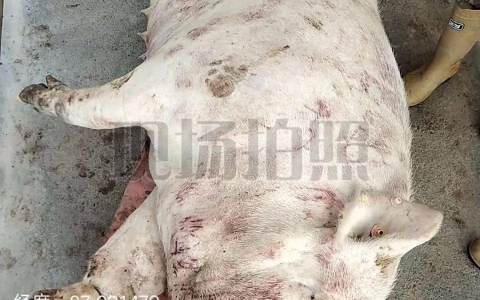
图 25.2 ASF亚临床感染,由于高度充血造成猪耳朵呈现紫色
有时可能出现鼻部出血, 便秘,呕吐, 轻度腹泻。有时出现肛门出血。有时能看到明显的皮疹,大量充血导致的皮肤发紫或青紫的斑点,这些斑点在四肢、耳朵、胸部和会阴部为不规则的紫色 (图 25.2)。可能还会出现血肿和一些坏死组织,这些症状在感染中等致病毒株的猪中较为明显。怀孕母猪常发生流产,并且也是疾病爆发的第一个临床现象。出现临床症状后7天,死亡率90%到100%不等。这种临床症状主要在以前没有发生过ASF的区域能观察到。
亚急性
亚急性的临床症状与急性类似,但没有急性严重。亚急性形式的特点是短暂的血小板减少, 白细胞减少症和多处出血性病变(Gómez‐Villamandos等,1997)。其他临床症状包括中度到高度的发烧、腹水、心包积液、多个器官水肿(胆囊或肾脏)、流产或脾肿大。死亡率从30%到70% 不等, 发病猪可能3–4周后恢复。这种临床症状可以地方性流行中观察到。
在撒丁岛, 存活的猪群含有ASFV抗体、间歇性病毒血症或亚急性症状, 没有临床症状或症状不典型(Murd等,2016a)。类似的田间现象也发生在俄罗斯联邦(Murd等,2016b) 和实验室条件下以东欧分离毒株攻毒猪群(Gallardo等,2016)。
慢性
ASF慢性病例主要发生在伊比利亚半岛 (葡萄牙和西班牙) 和受伊比利亚半岛毒株感染的感染国家。最近,接种了东欧分离毒株的感染猪业发现了慢性病例 (Gallardo等,2018)。
病理变化
ASFV有很多种组织病变,这取决于毒株的毒力。急性和亚急性以广泛性的出血和淋巴组织的坏死为病变特征。相反,在一些亚临床或者慢性病例中病变很轻或不存在病变(Mebus等,1983)。
病变发生的主要部位包括脾脏、淋巴结、肾脏和心脏(Sánchez‐Botija,1982)。

脾脏可呈现暗黑色、肿大、梗死和变脆,有时可见被膜下出血的大梗死灶(图 25.3)。

图 25.3 急性ASF肿大发黑的脾脏

图 25.4 ASF感染猪的肾脏皮质部表面有许多出血斑
淋巴结出血、水肿、易碎,经常类似暗红色血肿。由于充血和背膜下出血,淋巴结切面呈大理石样变。肾脏表面 (图25.4)及切面皮质部有斑点状出血,肾盂也有点状出血。有些病例可见带有出血的浆液性心包积液。在心内、外膜可见斑状出血。

急性ASFV还能观察到一些其他病变,例如腹腔内浆液性出血性渗出物,整个消化道黏膜水肿、出血。肝脏和胆囊充血,膀胱黏膜斑点状出血。胸腔积液及胸膜斑点状出血,以及常见肺水肿。脑膜、脉络膜、脑组织发生较为严重的充血(Mebus等,1983)。亚急性与急性的病变很类似,但亚急性的病变较轻。亚急性的主要病变特征是肾脏和淋巴结有较大的出血点。脾脏肿大出血。肺部水肿、出血,个别病例可见间质性肺炎。
在急性ASFV病例中,血管和淋巴器官会出现组织病理学病变。病变特征是出血、血管内形成微血栓以及内皮细胞的损伤,并伴有内皮下坏死细胞的大量聚集(Gómez‐Villamandos等,1995)。脾脏出血性肿大是急性和亚急性具有的主要特征病变,当病毒复制导致由于脾脏巨噬细胞坏死,破坏脾脏组织结构,从而出现这种脾脏出血性肿大。急性ASF的淋巴组织病变主要见于淋巴器官的T细胞区,但仍未观察到ASFV能在淋巴细胞中进行复制 (Carrasco等,1996; Mínguez等,1988)。
慢性ASF主要病变特征是呼吸道的变化,但是病变很轻或者不明显 (Gómez‐Villamandos等,1995;Mebus等,1983)。病变包括纤维素胸膜炎、胸膜黏连、干酪样肺炎和淋巴网状组织增生。纤维素性心包炎和坏死性皮肤病变也很常见。
诊断
实验室检测是准确诊断ASF所必需的,因为ASF的临床症状和病变与猪的其他一些出血性疾病很相似,比如猪瘟(猪霍乱)、猪丹毒和败血性沙门氏菌病。不能根据临床症状和总体病变来诊断是否感染ASF。在ASF疫区,对康复猪和只有非典型临床症状的猪进行诊断评估非常重要。很多实验室检查方法都可以用来诊断ASF。实验室诊断常检查的器官包括淋巴结、肾脏、脾脏、肺、血液和血清。对于野猪,腿骨的骨髓是理想的检测病料 (Gallardo等,2015)。病变组织可用于病毒的分离或检测。组织渗出液和血清主要用于抗体检测,但也可以用于检测病毒。
ASFV鉴定
检测和鉴定ASFV的最方便、最安全、最常用的技术是聚合酶链式反应 (PCR) (Agüero等,2003;Fernández‐Pinero等,2013;King等,2003)和血细胞吸附试验(HAT) (Malmquist 和 Hay,1960)。HAT是ASF的标准参考试验。
多种基于PCR的方法对检测当前流行的ASFV毒株为具有高度的一致性、特异性的和高敏感性。同时也适用于检测无细胞吸附和低毒力分离株。引物和探针都是根据病毒基因组中高度保守区域VP72设计的。也有采用实时荧光定量PCR(Fernández‐Pinero等,2013),给慢性感染猪群的检测提供了高度灵敏的方法。

由于血细胞吸附试验的特异性和敏感新,HAT检测范围非常广泛,HAT方法应该被用来评估疑似疫情,特别是当其他测试结果为阴性时,应该用HAT方法确诊。血细胞吸附试验是利用红细胞能吸附在体外培养的感染ASFV的巨噬细胞表面。在ASFV诱导的细胞病变出现前,红细胞能在巨噬细胞周围形成典型的玫瑰花环(Malmquist和Hay,1960)。但是尽管HAT试验是ASFV的最敏感方法,但应该指出的是,一些ASFV分离株能诱导巨噬细胞的病变,而不能出现红细胞吸附现象(Sánchez‐Botija,1982)。这些毒株可利用PCR或者直接免疫荧光方法进行确定。
血清学检测
已经有多种技术应用于检测抗ASFV抗体。ELISA(Sánchez-vizcaíno,1986;Sánchez‐Vizcaíno等,1979)推荐用于大规模筛查, 而间接免疫过氧化物酶反应检测,间接免疫荧光和免疫印迹法推荐用于血清学阴性或可疑样品的确认 (Gallardo等,2013,2015; Pastor等,1987)。
保存条件较差的样品或者血液样品而非血清样品(至少对于野猪来说)(Arias等,1993;Gallardo等,2015)可能对ELISA的敏感性有所影响,但是 "内部" 的以一种重组蛋白作为包被抗原的ELISA方法不受这方面的限制(Gallardo等,2006,2015)。
只要猪只感染超过1周,间接免疫过氧化物酶法与间接免疫荧光法就与 ELISA一样,具有高度的诊断灵敏性和特异性 (Arias和Sánchez-vizcaíno,2002)。免疫印迹法检测抗体确定是否阳性, 这种抗体在感染后2周出现, 当血清疑似保存不善时候推荐采用此方法(Arias,1993)。
ASF血清学诊断在疾病检测中发挥很大作用,因为到目前为止还没有行之有效的疫苗。当出现ASFV抗体时就证明被感染了。这对于从亚急性感染或不明显的感染中康复的猪群检测尤为重要,这些猪只通常产生高水平的ASFV特异性抗体:免疫球蛋白M(IgM)感染后4天能检测到,IgG感染后6-8天能检测到。病毒感染后抗体在体内大约持续6个月,有的在病毒感染几年后仍能检测到(Aria和Sánchez‐Vizcaíno,2002; Wilkinson,1984)。病毒进入体内早期就显现并随后持续存在的抗体,使得它们可用于检测亚急性和无明显症状的病例。
免疫
尽管ASFV疫苗研究取得了重大进展,但目前仍没有商业化疫苗。感染ASFV后存活下来的猪只能对所感染的相应病毒具有抵抗力,某些情况下,对异源毒株有交叉保护 (Boinas等,2004;Burmakina等,2016;King等,2011;Ruiz‐Gonzalvo等,1981)。ASFV 所涉及的免疫保护机制了解甚少, 虽然细胞免疫和体液免疫看起来是需要的 (Takamatsu等,2013)。免疫保护的主要障碍似乎是产生不了完全中和抗体和病毒分离株的巨大差异。注射感染猪只或其他感染动物的免疫血清,被动体液免疫对ASFV有部分保护,例如临床症状的延迟或缓解,病毒血症水平的降低和更高的存活率 (Onisk等,1994;Schlafer等,1984a,b;Wardley等,1985)。
体内和体外研究表明抗体在补体-介导细胞溶解和抗体-依赖细胞介导细胞毒性过程中有一定作用(Rock,2017;Takamatsu等,2013)。先天性免疫反应,例如自然杀伤细胞活性升高 (Leitão等,2001)和CD8+ T 淋巴细胞的特定亚群的细胞毒性活性也发挥重要作用(Martins和Leitão等,1994;Oura等,2005)。
预防和控制
任何情况下,只要有可疑的ASF感染猪,应该限制猪的流动,立即进行诊断。要记住,低毒力的ASFV毒株没有明显症状或病变。
目前还没有比较有效的措施或者疫苗来对抗ASFV。已经为寻找有效的疫苗进行了很多尝试。1963年在葡萄牙开始尝试第一个弱毒活疫苗,但没有成功(Manso‐Ribeiro等,1963)。后来,几种弱毒疫苗被证明有一定效果(King等,2011;Leitão等2001; O'Donnell等,2016;Reis等,2016),但在安全性和有效保护性方面仍存在很多不足。
因为缺乏疫苗和ASFV引起的巨大经济损失,也因为还没有控制该病的有效疫苗,所以保护ASF无疫区免受病毒的侵入变得非常关键。流行病研究表明,国际机场和港口中被污染的垃圾是ASFV重要的传染源(EFSA,2010)。因此,所有飞机和轮船上剩余的食物都应该被焚烧。
在一些发病温和和隐形感染的欧洲地区,比如撒丁岛,防控措施主要依靠控制猪和猪产品的流动,结合广泛的血清学调查来检测带毒猪。在ASF流行的非洲南方和东部地区,最重要的是控制天然宿主,也就是软蜱 (O.moubata)和非洲野猪疣猪,采取措施阻止它们和家猪接触。在欧洲东部,有必要认识到病毒自然带毒动物在生物循环的作用,应该控制家猪、野猪以及猪副产品的流动。在猪群中控制和净化ASF的方法因不同的地区和大陆、流行病的形势和情况、经济资源以及邻近地区的形势特点而不同。在1985-1995年期间,西班牙成立一个范围广泛的组织根除ASF,这个组织得到了欧盟的支持 (Arias和Sánchez‐Vizcaíno,2002a;Bech‐Nielsen等,1995)。没有疫苗也可以通过有效的应急措施根除 ASFV。每个国家都应该准备一套可以随时执行的应急措施,以防ASF的意外入侵。